병원성 진균 '칸디다 알비칸스' 활용 암/자가면역/신경퇴행성 등 발병 원인 규명 기대
[베리타스알파=김하연 기자] 강원대(총장 정재연) 의생명과학대학 분자생명과학과 이정신, 조용준 교수 공동연구팀이 병원성 진균 '칸디다 알비칸스(Candida albicans)'를 이용한 연구를 통해 유전자 발현이 히스톤 단백질의 변형 조합과 시간차를 둔 전환 메커니즘에 의해 정교하게 조절된다는 사실을 새롭게 밝혀냈다.
이번 연구 결과는 'Set1 is a critical transcriptional regulator in response to external signals in Candida albicans'라는 제목으로, 생명과학 분야 세계적 권위 학술지인 'Nucleic Acids Research'(IF 13.2, JCR 상위 1.9%) 2025년 7월 22일자에 게재될 예정이다.
'칸디다 알비칸스'는 인체의 입안, 장, 피부 등에 공생하는 효모균으로, 면역력이 약해질 경우 혈류 등으로 침투해 심각한 감염을 일으킬 수 있으며, 특히 외부 환경 변화에 따라 둥근 효모형에서 길게 뻗은 균사형으로 전환돼 병원성이 급격히 증가하는 특성을 지닌다.
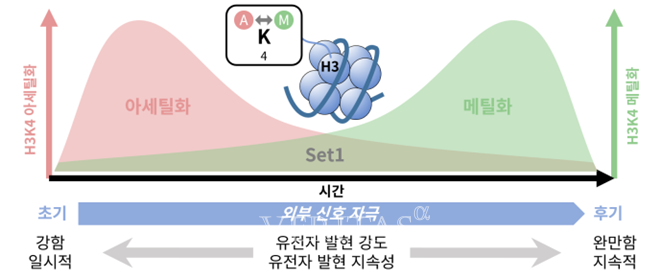
연구팀은 이 같은 형태 전환을 유도하는 유전자 발현을 조절하는 핵심 인자로 히스톤 H3 단백질의 K4(라이신4) 잔기에 메틸기를 부여하는 효소 'Set1'에 주목했다.
실험 결과, Set1이 제거된 진균에서는 외부 자극이 없어도 균사 형성과 관련된 유전자들이 무분별하게 활성화됐으며, 이로 인해 비정상적인 균사 성장과 병원성 증가가 관찰됐다.
특히, 이번 연구에서는 유전자 발현의 초기에는 H3K4 아세틸화가 먼저 일어나 빠르고 강한 유전자 발현을 유도하고, 이후 메틸화로 전환되며 발현이 안정적으로 유지되는 시간차 조절 메커니즘이 작동한다는 사실이 규명됐다.
이는 동일한 잔기에서 일어나는 아세틸화와 메틸화의 순차적 변형이 유전자의 반응 속도와 지속성까지 통제한다는 점에서 기존 유전자 발현 모델을 확장하는 중요한 발견으로 평가된다.
연구팀은 이를 바탕으로 '칸디다 알비칸스'를 후성유전학 연구에 적합한 정밀 모델 생물로 제안하며, 히스톤 변형 조절 메커니즘이 인간을 포함한 진핵생물 전반에 보존된 원리인 만큼, 향후 암, 자가면역질환, 신경퇴행성 질환 등 다양한 질환의 발병 원인 규명과 치료 타깃 개발에도 기여할 수 있을 것으로 기대하고 있다.
이정신 교수는 "히스톤 변형의 조합과 시간적 전환이 유전자 발현 조절에 얼마나 정밀한 역할을 하는지를 입증한 연구"라며 "인간 질병 연구에도 응용 가능한 후성유전 조절 타깃을 제시하게 돼 의미가 크다"고 밝혔다.
조용준 교수는 "진균 유전체 전반에서 히스톤 변형과 전사 반응을 통합 분석함으로써, 생명현상의 새로운 조절 메커니즘을 발견할 수 있었다"고 말했다.
김주은 박사(이정신 교수 연구팀, 제1저자)는 "유전자가 언제, 어떻게 켜지고 꺼지는지를 이해하기 위해서는 단순히 히스톤 변형의 유무를 넘어서 그 시간적 순서를 파악하는 것이 핵심"이라고 강조했다.
한편, 이번 연구는 ▲한국연구재단의 '기초연구사업(창의도전연구지원사업, 중견연구자지원사업)'▲강원대의 'G-램프(LAMP) 사업'▲국립보건연구원의 '병원기반 인간 마이크로바이옴 연구개발 사업'▲정보통신기획평가원의 '지역지능화혁신인재양성사업'의 지원을 받아 수행됐다.